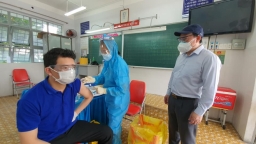
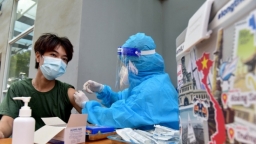
Hôm nay 3/8, Chủ tịch UBND tỉnh Bình Dương đã ký văn bản hỏa tốc gửi Bộ Y tế về việc xin tham gia chương trình tiêm thí điểm vắc xin Nano covax giai đoạn 3.
Đáng chú ý, số lượng vắc xin mà Bình Dương đăng ký thử nghiệm lên tới 200.000 người; chiếm khoảng 16% trong tổng số hơn 1,2 triệu người lao động tại các nhà máy, xí nghiệp trong toàn tỉnh.
Lý giải về việc này, UBND tỉnh Bình Dương cho biết việc đăng ký thử nghiệm vắc xin Nano covax từ văn bản đề xuất của Liên đoàn doanh nghiệp tỉnh, trong bối cảnh diễn biến dịch bệnh COVID-19 đang tiếp tục phức tạp, tác động lớn đến tính mạng, sức khỏe người dân, tình hình phát triển kinh tế và an ninh chính trị tại địa phương.
Trước đó, ngày 1/8, UBND tỉnh Khánh Hòa cũng có văn bản khẩn gửi Bộ Y tế, Học viện Quân y và Công ty cổ phần công nghệ sinh học dược Nanogen đăng ký tham gia thử nghiệm đợt 3 vắc xin Nano covax.

Vắc xin Nanocovax đã trải qua 2 giai đoạn thử nghiệm lâm sàng (giai đoạn 1 bắt đầu từ ngày 18/12/2020; giai đoạn 2 từ ngày 26/2/2021).
Trước vấn đề này, Thứ trưởng Bộ Y tế Trần Văn Thuấn cho biết Bộ rất ủng hộ các tỉnh tham gia thử nghiệm lâm sàng giai đoạn 3 của vắc xin Nano covax để mở rộng phạm vi nghiên cứu, từ đó đánh giá tính an toàn và hiệu quả của vắc-xin. Tuy nhiên việc đăng ký tham gia cần phải thực hiện đúng quy trình nghiên cứu.
Cụ thể, đầu tiên cần thông qua Hội đồng Đạo đức, sau đó sẽ tổ chức đánh giá theo đúng các tiêu chí trong đề cương. Đặc biệt, trong quá trình thử nghiệm phải đảm bảo thu thập, quản lý dữ liệu một cách khoa học, tin cậy và chính xác.
Thứ trưởng cũng nhấn mạnh "Bộ Y tế tuyệt đối không ủng hộ việc mua bán, mượn danh thử nghiệm lâm sàng để tiêm cho người dân khi chưa được các cơ quan chức năng cấp phép".
Vắc xin phòng COVID-19 Nano Covax do Công ty cổ phần công nghệ sinh học dược Nanogen phát triển từ tháng 5/2020, dựa trên công nghệ protein tái tổ hợp.
Vắc xin này đã trải qua 2 giai đoạn thử nghiệm lâm sàng (giai đoạn 1 bắt đầu từ ngày 18/12/2020; giai đoạn 2 từ ngày 26/2/2021).
Hiện vắc-xin Nano covax đang thử nghiệm giai đoạn 3 trên 13.000 người, chia làm 2 giai đoạn nhỏ (3a: 1.000 người và 3b: 12.000 người). Trong đó, hơn 4.000 tình nguyện viên được tiêm đủ 2 mũi.
Đánh giá bước đầu, vắc xin an toàn và có tính sinh miễn dịch tương đối cao. Tuy nhiên, cần chờ thêm thời gian và kết quả nghiên cứu để đánh giá về hiệu quả bảo vệ của vắc xin.
Song song với việc xin cấp phép sử dụng khẩn cấp có điều kiện, Công ty Nanogen cũng kiến nghị Bộ Y tế, Hội đồng Đạo đức trong Nghiên cứu Y sinh học Quốc gia xem xét việc triển khai nghiên cứu giai đoạn 3c (tiêm cho khoảng 500.000 - 1.000.000 người). Đồng thời, nghiên cứu trên trẻ em từ 12 đến 18 tuổi, sau khi được cấp phép.
Bộ Y tế đề nghị Công ty Nanogen trước ngày 15/8, phải gửi báo cáo dữ liệu nghiên cứu pha 2 và bước đầu pha 3, từ đó Bộ Y tế có số liệu gửi Hội đồng đạo đức và Hội đồng cấp phép của Bộ Y tế xem xét cấp phép trong tình trạng khẩn cấp. Nếu kết quả đánh giá tốt, Bộ sẽ báo cáo các cấp theo thẩm quyền để xem xét quyết định cấp phép khẩn cấp cho Nano covax.
V.LinhBạn đang xem bài viết Khánh Hòa, Bình Dương xin tiêm thử nghiệm vắc-xin Nano covax tại chuyên mục Nhịp sống Gia Đình của Gia Đình Mới, tạp chí chuyên ngành phổ biến kiến thức, kỹ năng sống nhằm xây dựng nếp sống gia đình văn minh, tiến bộ, vì bình đẳng giới. Tạp chí thuộc Viện Nghiên cứu Giới và Phát triển (Liên Hiệp Các Hội Khoa học Kỹ thuật Việt Nam), hoạt động theo giấy phép 292/GP-BTTTT. Bài viết cộng tác về các lĩnh vực phụ nữ, bình đẳng giới, sức khỏe, gia đình gửi về hòm thư: [email protected].
Tin liên quan
 Tags:
Tags: